
進化を続ける心血管系の統合的安全性評価
Axceleadでは、医薬品・医療機器の承認申請に必要な安全性試験を実施しています。前回のインタビューに続き、心血管系の安全性評価をテーマに、宮﨑主席研究員にお話を伺いました。宮﨑さんは長年、安全性薬理試験や心血管系の試験系についてご研究されていますが、世界中で使用されているあの解析方法の生みの親でした・・・!
2020年7月3日
INTERVIEW_02
宮崎 裕康
万有製薬(現:MSD)、Merck & Co., Inc.(米国)にて安全性薬理試験や試験系の研究に従事。 2018年7月より現職。 (非臨床開発・安全性評価部門 ディレクター。獣医師・博士)
INDEX >>
1心血管系安全性評価のコンセプトは、“統合的リスク評価”
宮﨑さん、本日はよろしくお願い致します!まずは基本的なところから伺いたいのですが、どういった背景から、医薬品開発において、心血管系の評価がより重要視されるようになったのでしょうか?
‘90年代に、欧米で、抗ヒスタミン薬Terfenadineによる” Torsade de Pointes”という致死性不整脈が報告され、その他の非抗不整脈薬からも幾つか、致死性不整脈の原因とされるQT延長作用が有ることが分かり、市場から相次いで撤退したことがありました。以来、医薬品開発において、催不整脈作用の有無を正確に評価することが重要な課題となっていきました。これに呼応して試験の方法も整備され、’97年にCPMP*から、非抗不整脈薬による潜在的QT延長の評価に関する“Points to Consider”が出され、QT延長を評価する試験系の議論が活発になりました。日本では製薬協と安研協の共同研究プロジェクト ”QT PRODACT“ が立ち上がり、ガイドラインの基盤データが構築され、日米欧で’05年に非臨床のICH**-S7B***、臨床のICH-E14****ガイドラインが制定されました。S7Bは2000年に合意された安全性薬理試験ガイドラインS7Aを補完する位置づけになっています。
* CPMP:Committee of European Agency for Proprietary Medicinal Products、** ICH:日米 EU 医薬品規制調和国際会議、*** S7B:ヒト用医薬品の心室再分極遅延(QT間隔延長)の潜在的可能性に関する非臨床的評価、**** E14:非抗不整脈薬におけるQT/QTc間隔の延長と催不整脈作用の潜在的可能性に関する臨床的評価
実際の試験はどのように実施されているのでしょうか?
S7Aガイドラインの評価項目である血圧・心拍数・心電図と、S7BのQT延長リスクは、一般的にはテレメトリーシステム*を使って同じ試験の中で一緒に評価されています。In vitroは独立して実施しますが、in vivoの試験デザイン、結果の評価にあたってはin vitroの結果情報が必要不可欠になります。
* テレメトリーシステム:無拘束の動物の体に装着したセンサーを通して、長期的に心電図、血圧、心拍数、呼吸数及び体温などのバイタルサインを遠隔操作により取得し解析するコンピューター化されたシステム
なるほど。In vitroの試験も加味して評価されるんですね。
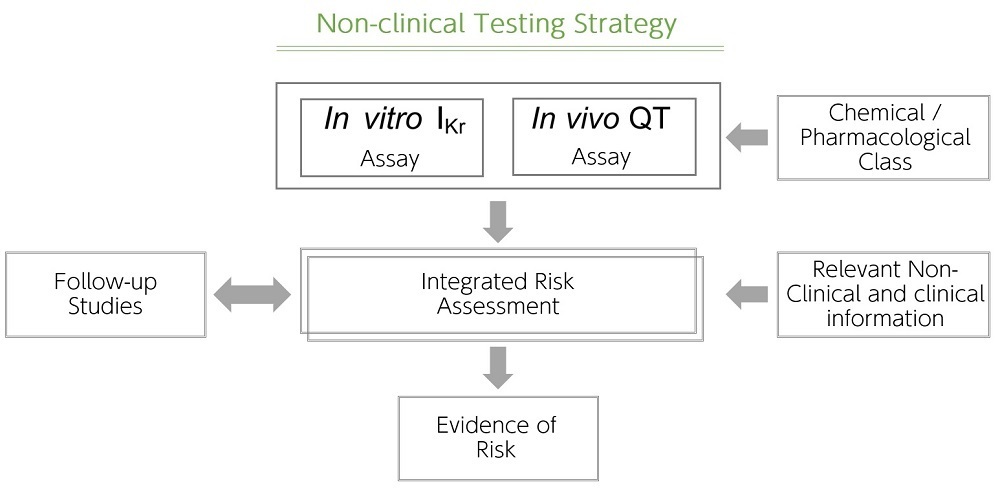
そうですね。 S7Bのガイドラインに書かれている様に、QT延長のリスクは単体の試験で評価するのではなく、“統合的リスク評価”と言って、in vitroからin vivo、臨床までのデータを統合的に捉えてリスクを評価することが重要です。また安全性薬理試験だけでなく、化合物の構造や毒性試験で得られたた所見も含め、総合的に評価しています。
※引用 ICH S7Bガイドライン
このガイドラインに関して、昨今何か変化などはありましたか?
はい。E14では非臨床試験のデータによって臨床のQT試験の必要性を減ずることができるとしていますが、
非臨床データを臨床のQT試験のデザインやデータ解釈にどのように使用するかについてコンセンサスはありませんでした。 S7Bも、被験物質がhERGを阻害するか、もしくはQTを延長した場合、フォローアップ試験を実施することを推奨していますが、具体策は不明確なままでした。 そうした中、FDA のCiPA Initiative*によって、新しい技術によるアプローチが提案され、S7B/E14 Q&Aとして、ICH Assemblyでその内容が議論されています。
* CiPA Initiative:Comprehensive In Vitro Proarrhythmia Assay (CiPA) Initiative
2最新動向を踏まえた最適なストラテジーの立案
様々な新しいアプローチ方法が出てくる中で、最適な試験系を選択して試験計画を組んでいくのは、より難しくなりそうですね。
そうですね、新しい技術やアプローチが登場すると、どの試験をどのタイミング、どの順番で実施するかというスクリーニング戦略や試験計画が自ずと変わってきますので、新旧それぞれのアプローチ方法の特徴を十分理解しておく必要があります。でも、Axceleadには心強い専門家がいるので安心してください。先ほど触れたFDAのCiPA Initiativeですが、日本にも同じコンソーシアムが立ち上がっていて、そのリーダーをされていたのが、前回インタビューしていた高砂さん*です! 高砂さんとも議論しながら、新しい技術やアプローチを取り入れつつ、最適なスクリーニング戦略をお客様にご提案し、in vitroからin vivoまで総合的に心血管系のリスク評価をできるのがAxceleadの強みだと思います。
* Interview vol.1 「AxceleadのhERG currentアッセイの魅力に迫る!」(高砂 主席研究員)
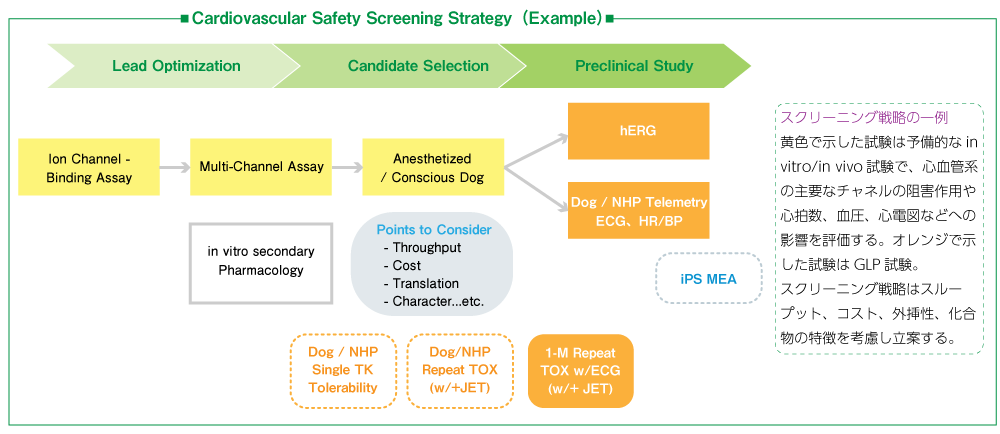
前回のインタビュー時に、高砂さんも「in vitroからin vivoまで統合的な心機能毒性評価に強いAxceleadを目指したい」と仰っていました!具体的にはどういった連携になるのでしょうか?
高砂グループでは、in vitroを中心に創薬研究の早期ステージで必要な試験系をほぼ網羅していますし、私達のグループも予備検討を含めてIND申請に必要な試験に対応していますので、被験物質の多様なプロファイルに合わせた統合的なスクリーニング戦略を立案、実施できます。また、予測していなかった有害作用が出てきた場合も、両グループで情報を交換しながら、最適な解決策をご提案していこうと考えています。
In vitroからin vivoまでトータルでストラテジーを組むことができれば、研究スピードの短縮やコスト削減にも繋がりますか?
そうですね。試験系の選択や順番、タイミングによって、開発スピードやコストも大きく変わってきます。また、医薬品開発の成功確率は非常に低いので、致命的な有害作用をできるだけ早い段階で検出することも大切です。Axceleadの研究員は実際に自身で医薬品を研究開発してきた製薬企業出身者が多いので、その感覚は骨身に染みており、これまでの経験から得たノウハウを最大限活用し、お客様のコスト削減や開発のスピードアップにも貢献したいと考えています。
